研究グループの紹介
わが国を含む先進国において、急速に迎える高齢化が大きな社会問題のひとつになっています。65歳以上の高齢者の約10%が認知症患者と考えられています。認知症患者数は、2020年には30万人を超えると予測されていましたが、直近の疫学調査(2013年厚生労働省発表)では、既に460万人の認知症患者と、400万人の予備軍が存在すると推計予測されました。その約60%がアルツハイマー病です。アルツハイマー病の原因はアミロイドβ蛋白であるとするアミロイドカスケード仮説(オリゴマー仮説)が提唱され、この仮説に基づいた創薬がされ、大きな期待を持って臨床治験が行われてきました。しかし、脳内のアミロイドは減少させるものの、認知機能を改善できた薬剤は残念ながらこれまでにありません。治療法再考の必要性が検討され、現在前臨床段階の投与や抗オリゴマー抗体の有用性が検討されようとしています。当教室の認知症グループでは、記憶メカニズム解明の観点からアルツハイマー病研究を行っています。教室で発見した海馬記憶調整系として重要なコリン作動性神経の制御因子として、海馬由来コリン作動性神経刺激ペプチド(hippocampal cholinergic neurostimulating peptide: HCNP)を中心にアルツハイマー病の病態解明と新たな創薬基盤研究を行っています。名古屋市立大学神経内科教室では、教室で発見したペプチドの観点からアルツハイマー病病態解明に迫るべく、オリジナリティーの高い研究内容を世界に発信しています。
研究紹介
疫学研究から、糖尿病や高血圧患者において認知症(アルツハイマー病)の発症率が2-3倍に増加することが知られています。また、ナンスタディーにおいては神経病理学的に非常に軽微なアルツハイマー病変群のうち約2割は生前認知症を呈し、反対に非常に高度な病理変化を示す群の約2割は生前認知症を呈していなかったことが知られています。また、1970年代の神経病理の検討でも、老人斑数は認知症の程度には相関せず、一方神経原線維変化数は認知症の程度に相関することも知られています。分子生物学的研究手法の発達により、家族性アルツハイマー病がたった一つの点変異により引き起こされること、他の家系では是アミロイド前駆体タンパクからの切断酵素の異常でもアルツハイマー病が惹起されることが明らかにされましたた。さらに、アミロイド前駆体タンパクが制御される21番染色体トリソミーであるダウン症研究の結果から、アミロイドカスケード仮説が揺るぎないものとして考えられています。しかし、家族性アルツハイマー病患者は若年において発症するのに対して、弧発性アルツハイマー病では70-80歳に発症のピークがあり、加齢による変化(虚血や代謝能低下など)の影響が複合的に加味されている可能性を考慮に入れる必要があると考えられます。このことが、病理変化の程度と認知機能障害の程度が相関しないことを説明しうる原因ではないかと考え、弧発性アルツハイマー病研究を行っています。
我々の研究室で発見したペプチドは、記憶調節系のコリン作動性神経の制御因子のひとつです。現在臨床応用されている抗認知症薬は、このコリン作動性神経の働く薬剤であり、アルツハイマー病をはじめとして、この神経活動が重要であることは人においても明らかにされています。また、このペプチドの前駆体タンパクが非常に重要な生理機能を有していることが明らかになってきました。現在、遺伝子モデル動物を作成し、記憶メカニズムへの生理機能の関与、アルツハイマー病病態への関与について研究を進めています。新たな抗アルツハイマー病薬開発の創薬標的になりえる可能性を念頭に基盤研究を行っています。
臨床研究では、早期バイオマーカーの探索やfMRIを用いた早期診断法の開発を行っています。また、リハビリ科との連携を行い、簡易的認知症スクリーニング検査法の開発を目指しています。最近、当大学(早野順一郎教授)が採択された“未来医療人育成プログラム なごやかモデル”に参画し、高齢化した都市集合住宅における医学系学生教育と高齢者観察研究を開始しています。今後、認知症を中心としたコフォート研究を行い、認知症発症率・簡易式スクリーニング法の開発・早期診断バイオマーカーの探索を行いながら、認知症・高齢者在宅医療介護支援システム構築を行っていく予定です。
主な研究紹介
中隔核海馬コリン作動性神経活動におけるHCNPおよびその前駆体タンパクの生理機能
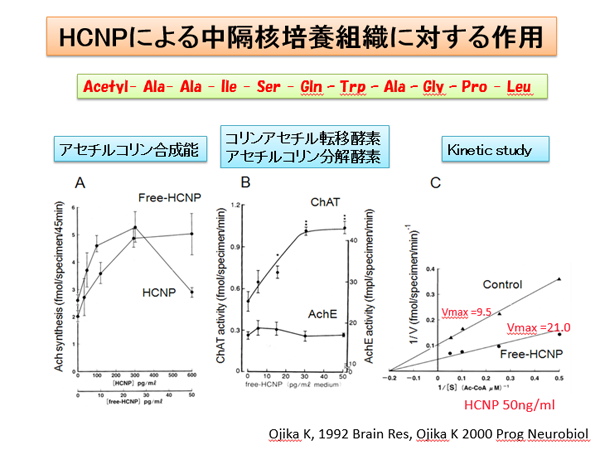
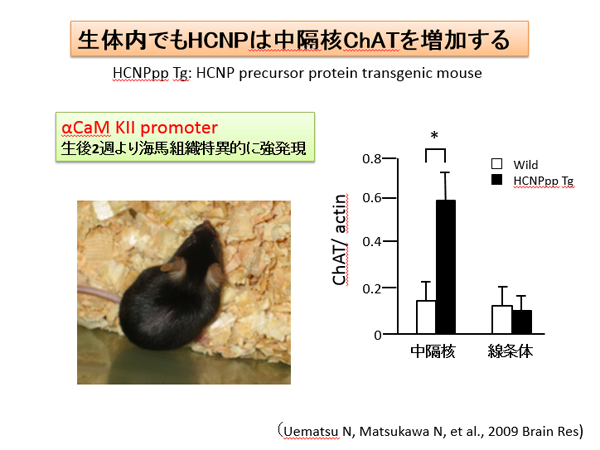
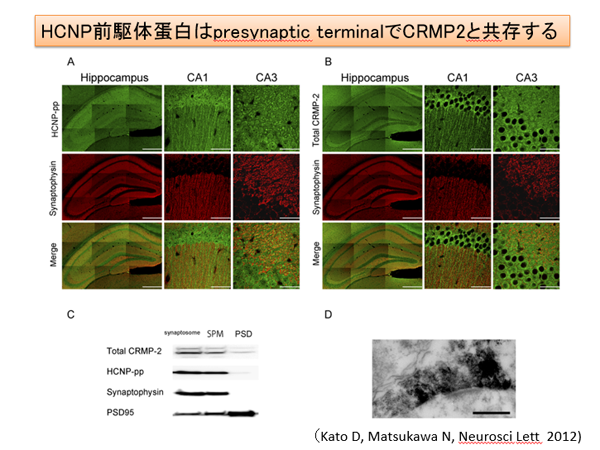
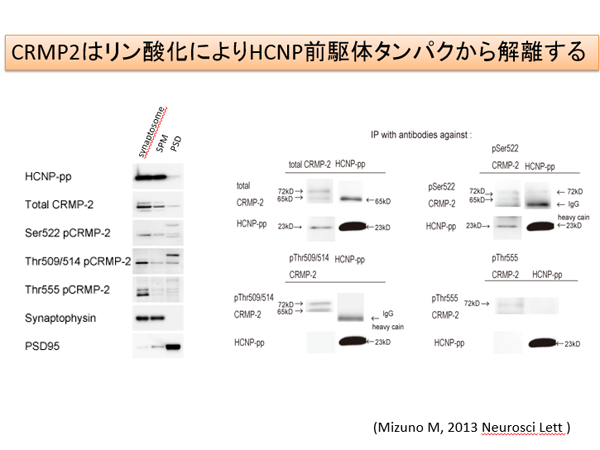
我々の研究室にて発見した神経ペプチド(hippocampal cholinergic neurostimulating peptide: HCNP)は186アミノ酸からなる前駆体タンパクが存在します。最近、HCNP前駆体トランスジェニックマウスを用いたproteomics解析により、海馬内のCollapsin response mediator protein (CRMP)-2が増加していることが明らかになりました(Kanamori T Brain Res 2010)。活性型である非リン酸化CRMP-2は神経軸索進展に重要であると考えられています。最近では、CRMP-2は成熟神経週末に存在し、Cav 2.2と相補的に神経可塑性に関与していること、またmicrotubule-associated protein(MAP)のひとつであることが報告されました。HCNP前駆体は、この非リン酸化CRMP-2と海馬神経週末に存在し、CRMP-2のリン酸化により解離することが明らかになりました(Kato D Neurosci Lett 2012, Mizuno M Neurosci Lett 2013)。現在、神経可塑性への関与を検討しています。
アルツハイマー病態におけるHCNPおよびHCNP前駆体の関与
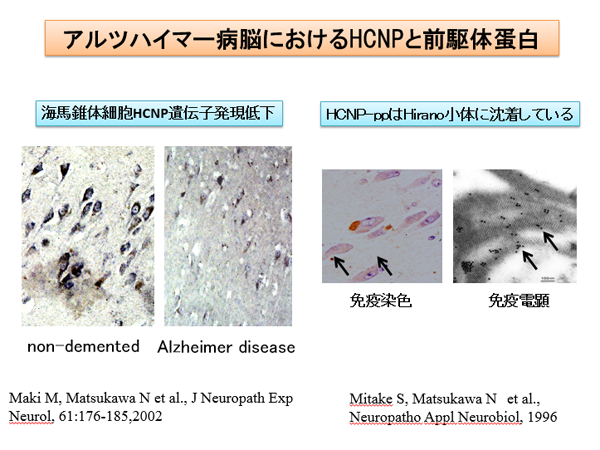
早期より海馬錐体細胞のHCNP遺伝子発現は低下しています。また、アルツハイマー病脳アンモン角神経細胞内に増加することが知られている平野小体はβチューブリンの凝集体であることが知られています。この平野小体に特異的にHCNP関連物質が沈着しています。また、リン酸化CRMP-2がアルツハイマー病脳において、増加していることが知られています。現在、アルツハイマー病態へのHCNPおよびその前駆体蛋白の関与を検討しています。
(Maki M: J Neuropath Exp Neurol 2002, Mitake S: Neuropatho Appl Neurobiol 1996)
神経精神疾患(うつ病)におけるHCNPおよびHCNP前駆体の関与
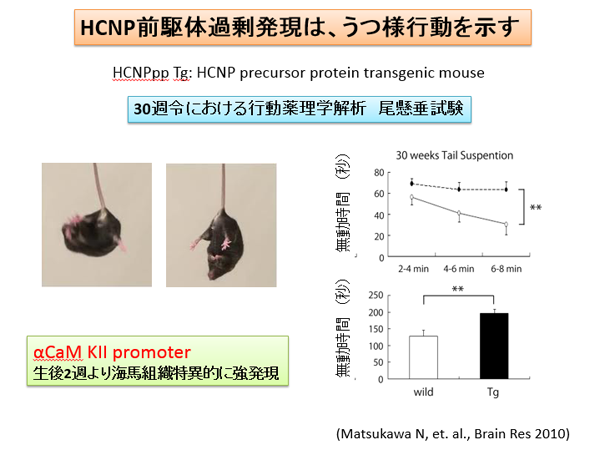
精神神経疾患における海馬の重要性が明らかになってきています。また、うつ病とアルツハイマー病との関連性は病態解明の上でも重要な観点です。HCNP前駆体トランスジェニックマウスは、うつ様行動を示すことが明らかになりました。海馬神経活動に何らかの影響を与えている可能性が示唆されます。
(Matsukawa N: Brain Res 2010)
神経発生におけるHCNPおよびHCNP前駆体
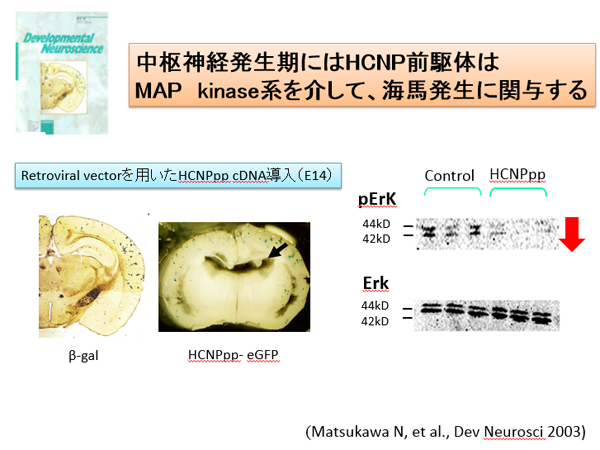
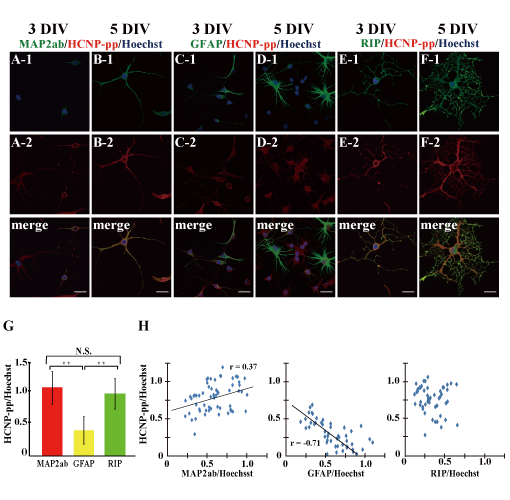
HCNP前駆体蛋白は、多機能蛋白であることが知られてきています。がん細胞の細胞分裂は、細胞内のcRaf-MEK-Erkリン酸化シグナルにより制御されています。このリン酸化抑制因子としてHCNP前駆体タンパクが働いていること(cRaf kinase inhibitory protein: RKIP)が報告されました。我々の行った実験では、胎生14日のラット脳室内にレトロウイルスを用いてHCNP前駆体を過剰発現したところ、Erkのリン酸化を抑制し、海馬形成を抑制しうることが分かりました。また、ラット海馬由来神経幹細胞にはHCNP前期体蛋白が発現しており、発現を抑制するとGFAP陽性アストロサイトに誘導されることが分かりました。このように、神経発生、神経細胞系譜にHCNP前駆体が関与している可能性があります。また、脳虚血モデルラットに誘導される海馬内神経幹細胞においても、HCNP前駆体タンパクの発現と細胞系譜との関連性が示唆されました。今後、HCNP前駆体過剰発現により、脳虚血後に誘導される神経幹細胞を神経に誘導しえるかを検討したいと考えています。
(Matsukawa N: 2003 Dev Neurosci, Sagisaka T: Brain Res 2010, Toyoda T: Cell Transplant 2012)
メンバー紹介
- 大喜多賢治 講師(平成7年卒)
- 医学博士 内科専門医・指導医 神経内科専門医・指導医
臨床神経・認知症・パーキンソン病 - 加藤大輔 臨床研究医(平成14年卒)
- 医学博士 内科認定医 神経内科専門医
臨床神経・認知症・生化学・分子生物学・分子イメージング - 金森哲子 臨床研究医(平成15年卒)
- 医学博士 内科認定医
臨床神経・生化学・分子生物学 - 水野将行 臨床研究医(平成16年卒)
- 医学博士 内科認定医 神経内科専門医
臨床神経・認知症・生化学・分子生物学 - 佐藤豊大 大学院生(平成19年卒)
- 内科認定医 神経内科専門医
臨床神経・生化学・電気生理 - 櫨啓子 実験助手
- 生化学・分子生物学・動物飼育
